
浏览:41 日期:2024-03-25
近日,暨南大学药学院叶文才教授和张冬梅研究员课题组连续在国际权威学术期刊Nature Metabolism(IF=20.8)和Advanced Science(IF=15.1)在线发表题为“ENO2-derived phosphoenolpyruvate functions as an endogenous inhibitor of HDAC1 and confers resistance to antiangiogenic therapy”和“TCAF2 in pericytes promotes colorectal cancer liver metastasis via inhibiting cold-sensing TRPM8 channel”的研究论文,分别报道了代谢重编程介导肿瘤抗血管生成药物耐药的新颖机制,以及周细胞离子通道调控肿瘤血行转移的分子机制。

摘自Nat Metab, 2023:10.1038/s42255-023-00883-y

摘自Adv Sci. 2023:e2302717.
结直肠癌(colorectal cancer,CRC)是全球发病率排名第三、致死率排名第二的恶性肿瘤,肝转移是结直肠癌致死的主要原因。Regorafenib和Bevacizumab 等抗血管生成药物广泛应用于转移性CRC的临床治疗,但耐药频发,患者预后差,亟需解决方案。该团队从代谢重编程的角度研究了肿瘤抗血管生物药物耐药的调控新机制,发现糖酵解酶烯醇化酶ENO2是驱动CRC抗血管生成药物耐药的关键因素。机制研究表明ENO2代谢产物磷酸烯醇丙酮酸(PEP)能选择性与HDAC1结合并抑制其活性,从而提高β-catenin乙酰化并激活β-catenin通路,进而促进CRC细胞恶性行为和耐药;联合使用ENO2抑制剂能有效克服CRC抗血管生成药物耐药(Nat Metab, 2023:10.1038/s42255-023-00883-y)。
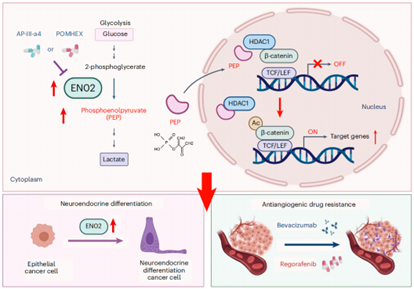
肿瘤细胞ENO2代谢重编程促进抗血管生成药物耐药的作用机制图
血行转移是CRC肝转移的最主要途径,而原发灶肿瘤细胞渗入肿瘤血管是血行转移的关键限速步骤。作为肿瘤血管的“守门员”,周细胞监管着肿瘤细胞渗入血管的过程,但调控机制仍不明确。该团队首次使用显微分离结合周细胞培养基条件培养的方法,从CRC患者手术切除的肿瘤组织中分离获得了周细胞,并通过蛋白质组学研究发现,CRC肝转移病人来源的肿瘤周细胞高表达TRP 通道相关因子2(TRP channel-associated factor 2,TCAF2)。TCAF2通过抑制TRPM8冷感受离子通道TRPM8的表达和活性,诱导肿瘤周细胞分泌Wnt 5a,激活STAT3信号通路促进肿瘤细胞EMT和血行转移。TRPM8通道激动剂薄荷醇能有效抑制CRC肝转移(Adv Sci. 2023:e2302717)。
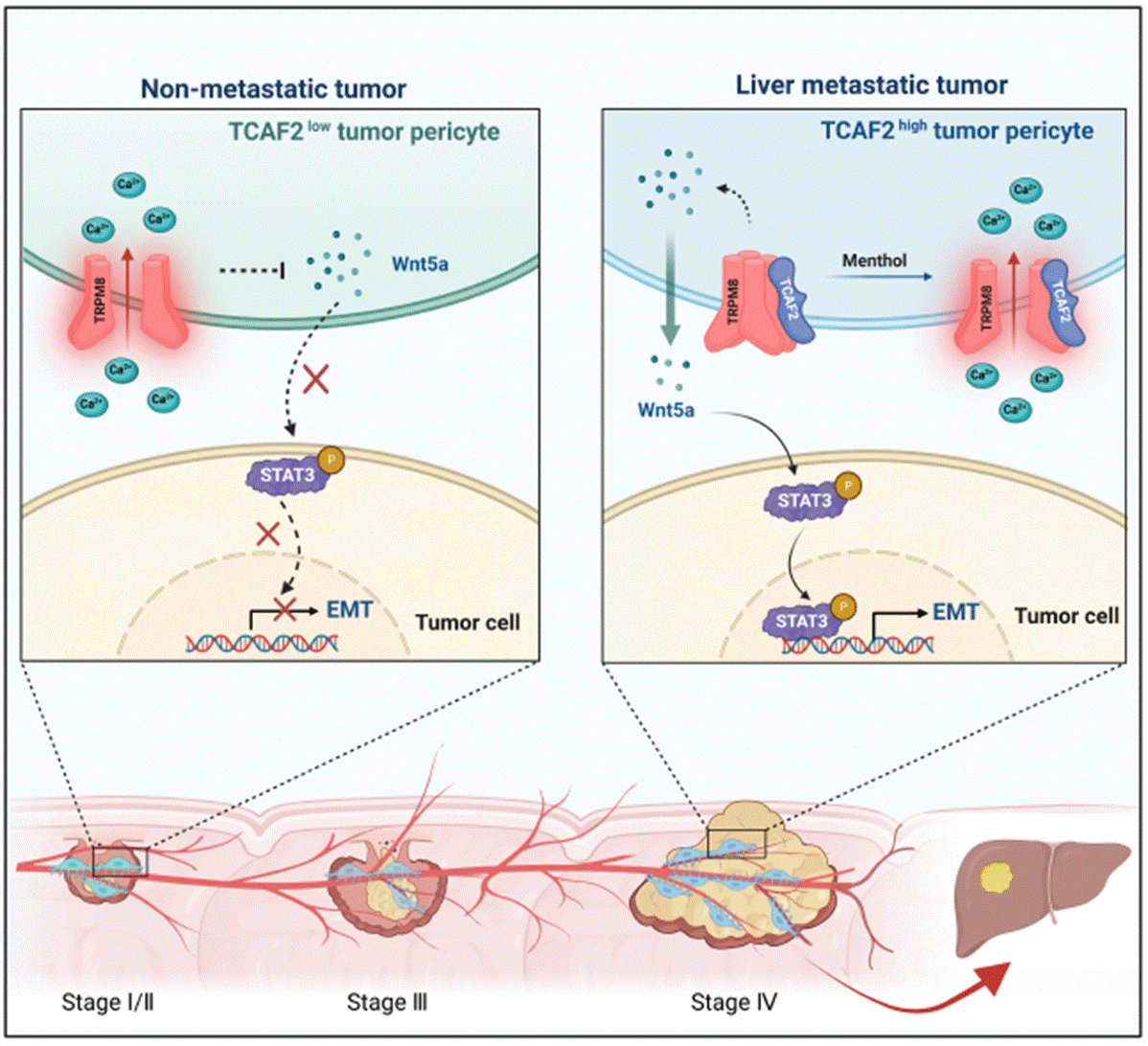
周细胞TCAF2促进结直肠癌肝转移的作用机制图
近年来,叶文才和张冬梅课题组基于血管靶向药物耐药和肿瘤转移的临床难题,主要围绕“发现血管靶向药物耐药和肿瘤转移的调控新机制和新靶标”以及“克服耐药和抑制转移的新药发现研究”开展研究,从肿瘤细胞代谢重编程和周细胞的新颖角度,利用单细胞转录组测序、蛋白组学、基因组学等多组学分析,结合生物信息学、分子生物学等技术以及该团队构建的“多模态时空生物成像系统”,在分子、细胞、类器官、动物和临床标本等多水平,系统揭示了肿瘤细胞和肿瘤周细胞异质性及其介导血管靶向药物耐药和肿瘤转移的调控新机制,发现肿瘤细胞ENO2(Nat Metab, 2023:10.1038/s42255-023-00883-y)、ASCT2(Drug Resist Updat, 2023;69:100975),以及肿瘤周细胞FAPα(J Clin Invest, 2022; 132(19):e157399;J Clin Invest, 2017;127(10):3689-3701)、TCF21(Gut, 2023;72(4):710-721)、TCAF2(Adv Sci, 2023:e2302717)、Gas6(J Extracell Vesicles,2021;10(7):e12096;Cancer Lett, 2022;524:131-143)等多个关键调控分子,为解决耐药和转移的临床难题提供潜在新颖靶标。
针对潜在新靶标,该团队从自建的含有1万余个天然产物及其衍生物的化合物库中筛选活性分子,经人工智能辅助设计、结构修饰、活性筛选和成药性评价,获得10余个肿瘤细胞或周细胞靶向抗肿瘤新药先导物(Mol Cancer, 2022;21:52;Signal Transduct Target Ther, 2020;5(1): 214;J Immunother Cancer, 2023;11(6):e006381;J Med Chem,2017;60:5320-5333;Cancer Lett, 2021;503:32-42;Cancer Lett,2018;418:239-249; Eur J Pharmacol, 2020;887:173379.)。其中,FAPα酶激活式前药Z-GP-DAVLBH是首个具有自主知识产权的周细胞靶向抗肿瘤新药候选物(中国发明专利ZL201310138241.8, ZL201310738860.0,ZL201480022198.1; PCT专利2014/000192,美国专利US10377774 B2,日本专利JP6250710,澳大利亚专利AU2014253584 B2,印度专利ID342171,欧洲专利EP2987794,英国专利BP2987794,德国专利DE602014026358.5,法国专利FR2987794),目前该团队正在对Z-GP-DAVLBH进行系统的临床前研究,有望为克服血管靶向药物耐药和抑制肿瘤转移提供潜在治疗药物。
上述系列研究工作得到了国家自然科学基金、广东省“珠江人才计划”本土创新科研团队、广东省重点领域研发计划等项目的大力支持。
论文链接:https://www.nature.com/articles/s42255-023-00883-y
https://onlinelibrary.wiley.com/doi/10.1002/advs.202302717